
Conforme IN 138, capítulo 1, sessão lll, art. 3° item XXIX – validação de processo é: uma “evidência documentada de que um processo, operado dentro dos parâmetros pré-estabelecidos, pode desempenhar suas funções efetivamente e reprodutivamente para a produção de um medicamento dentro de suas especificações e atributos de qualidade pré-estabelecidos.”
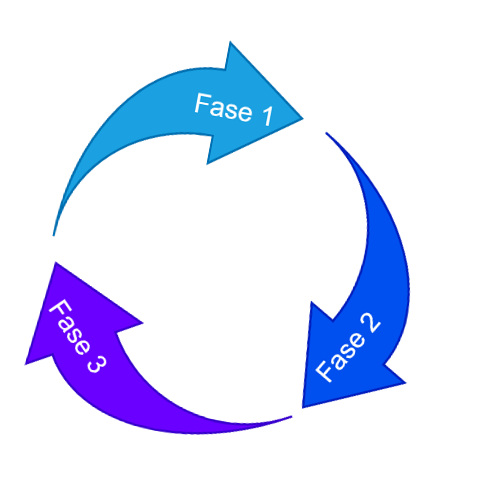
A validação de Processo e dividida em 3 validações distintas:
Para que possa ser realizado uma validação, o processo de desenvolvimento do produto deve ser robusto e bem-sucedido, a fim de garantir a efetividade e reprodutibilidade do processo em estudo. Dessa forma a validação de processo deve considerar a seguintes fases:
Descubra como podemos ajudar sua empresa a alcançar novos patamares de eficiência e qualidade!
Fale Conosco
Atendimento via E-mail
Lapa,
São Paulo - SP
CEP: 05074-000

Nossos resultados vêm da atuação de profissionais comprometidos, que buscam melhorar a vida das pessoas, por isso oferecemos Excelência em Ciências da Vida!
Quality Compliance Consultoria Farmacêutica Ltda CNPJ: 27.372.308/0001-14
Copyright © 2024. Todos os Direitos Reservados by VTADDONE