
Según IN 138, capítulo 1, sesión lll, art. 3º punto XXIX – validación del proceso es: “evidencia documentada de que un proceso, operado dentro de parámetros preestablecidos, puede desempeñar sus funciones de manera efectiva y reproductiva para la producción de un medicamento dentro de sus especificaciones y atributos de calidad preestablecidos”.
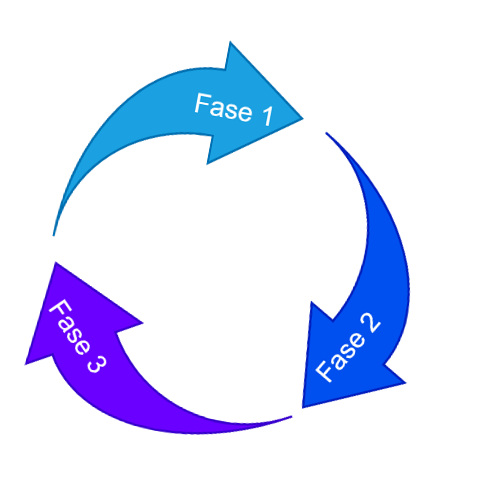
La validación de procesos se divide en 3 validaciones distintas:
Para que se lleve a cabo la validación, el proceso de desarrollo del producto debe ser robusto y exitoso, para garantizar la efectividad y reproducibilidad del proceso en estudio. Por lo tanto, la validación del proceso debe considerar las siguientes fases:
¡Descubra cómo podemos ayudar a su empresa a alcanzar nuevos niveles de eficiencia y calidad!
Hable con nosotros
Servicio vía correo electrónico
Lapa,
São Paulo - SP
CEP: 05074-000

Nuestros resultados provienen del trabajo de profesionales comprometidos, que buscan mejorar la vida de las personas, por eso ofrecemos Excelencia en Ciencias de la Vida!
Quality Compliance Consultoria Farmacêutica Ltda CNPJ: 27.372.308/0001-14
Copyright © 2024. Todos los derechos reservados por VTADDONE